L’attività del gruppo di ricerca è finalizzata all’identificazione di metodi per potenziare la capacità adattativa e rigenerativa del muscolo scheletrico. In particolare, il gruppo di ricerca studia il ruolo dell’attività elettrica e dei fattori trofici locali che caratterizzano il microambiente della fibra muscolare adulta e la nicchia delle cellule satelliti, ovvero le cellule muscolari progenitrici responsabili della miogenesi postnatale. Sono investigati i meccanismi molecolari responsabili del controllo dalla comunicazione neuromuscolare nelle fibre muscolari scheletriche adulte e della capacità rigenerativa del muscolo scheletrico analizzando il processo della miogenesi in vitro, mediante l’impiego di colture primarie di cellule satelliti (murine e umane) e linee cellulari miogeniche. In particolare, viene studiato il ruolo della meccanotrasduzione nella determinazione della capacità di proliferazione e di differenziamento miogenici. Gli approcci sperimentali utilizzati includono: la stimolazione elettrica di campo, l’elettrofisiologia, tecniche di biochimica e di sintesi di proteine della matrice, l’immunofluorescenza e la videomicroscopia.
L’obiettivo finale è la messa a punto di nuove strategie per contrastare la riduzione della capacità funzionale del muscolo scheletrico durante l’invecchiamento e nelle patologie riguardanti l’apparato neuromuscolare caratterizzate da atrofia muscolare.
Attualmente, le principali linee di ricerca sono tre.
1) Plasticità della giunzione neuromuscolare
Nella fibra muscolare scheletrica, l’espressione, la distribuzione e la stabilità del recettore acetilcolinico nicotinico (nAChR) nella regione di placca sono controllate da fattori neurotrofici rilasciati dal motoneurone e dall’attività elettrica della fibra muscolare stessa. La denervazione causa una diminuzione della densità dei nAChR a livello di placca, una riduzione della sua emivita, la transizione dell’espressione dalla isoforma adulta (e-nAChRs) alla isoforma embrionale (g-nAChRs) che appare distribuita sull’intera membrana della fibra muscolare.
Il controllo esercitato dall’attività elettrica muscolare è mediato da variazioni della concentrazione intracellulare di Ca2+ ([Ca2+]i). Si ipotizzano variazioni subsinaptiche della [Ca2+]i governate da recettori per l’inositolo 1,4,5-trisfosfato (IP3R) attraverso le quali la fibra muscolare codificherebbe la frequenza di stimolazione del motoneurone e la stabilizzazione dei nAChRs giunzionali. In particolare, è stato proposto un “dialogo” funzionale tra il nAChR e l’soforma 1 del IP3R (IP3R1). E’ interessante sottolineare che in condizioni patologiche, l’aumentata attività dei IP3R1 subsinaptici potrebbe essere la causa di variazioni locali abnormi della [Ca2+]i che caratterizzano la sindrome miastenica congenita da canale lento e la degenerazione della giunzione neuromuscolare nel caso di eccessiva attivazione colinergica.
Sebbene siano state formulate diverse ipotesi sul ruolo delle variazioni subsinaptiche della [Ca2+]i, non è noto se e come l’innervazione controlla l’organizzazione del deposito IP3-sensibile subsinaptico. Con questa linea di ricerca, ci proponiamo di studiare i meccanismi molecolari che controllano la distribuzione e l’attività dei IP3R1 subsinaptici e gli effetti da essi generati sulla stabilità metabolica dei nAChR giunzionali.
I risultati della ricerca potranno contribuire alla conoscenza degli aspetti funzionali della plasticità della sinapsi periferica in condizioni patologiche e in condizioni ambientali estreme (microgravità). Essi potranno essere utili per individuare strategie innovative per contrastare le patologie neuromuscolari caratterizzate da una alterata stabilità dei nAChR giunzionali e gli effetti avversi della microgravità sulla funzionalità della giunzione neuromuscolare, che sono tra i principali responsabili della severa atrofia muscolare degli astronauti durante le missioni spaziali. Per questo motivo la linea di ricerca è stata finanziata dall’Agenzia Spaziale Italiana (Progetti NEMUCO DC-VUM-2016-068 e NEMUSY DC-DSR-UVS-2022-212).

Distribuzione delle isoforme embrionale (g-nAChRs) e adulta (e-nAChRs) dei nAChR.
La localizzazione dei nAChRs è influenzata sia dalla denervazione che dalla microgravità.
2) La stimolazione elettrica delle cellule muscolari in coltura come modello di esercizio fisico in vitro
L’attivazione delle fibre muscolari scheletriche da parte dei motoneuroni spinali può essere mimata attraverso tecniche di elettrostimolazione utilizzate nelle procedure di riabilitazione per contrastare disabilità neuromuscolari dovute all’età, l’atrofia indotta da microgravità durante i voli spaziali fino alla degenerazione in pazienti paraplegici. Nelle condizioni in cui non è possibile effettuare esercizio fisico, la stimolazione elettrica mima effetti benefici stimolando le cellule satelliti, aumentando la dimensione delle fibre muscolari scheletriche e modulando la funzione mitocondriale. Studiare i meccanismi molecolari attraverso cui l’esercizio fisico influenza le potenzialità funzionali del muscolo scheletrico e di altri tessuti, incluso il sistema nervoso, è di grande rilevanza.
Utilizziamo modelli di esercizio fisico in vitro basati su opportune elettrostimolazioni di campo di cellule muscolari scheletriche in coltura mimando la contrazione moderata o intensa e i corrispondenti valori delle specie reattive dell’ossigeno (ROS) per studiare poi gli effetti poco studiati di specifici antiossidanti utilizzabili per la salute umana. Studiamo anche come l’attività elettrica partecipa alla regolazione autocrina e paracrina della capacità rigenerativa delle cellule staminali del muscolo scheletrico. In particolare, analizziamo la produzione di fattori trofici locali e delle miochine, che agendo come ormoni, influenzano l’attività di altri organi come l’osso e il cervello.
Grazie a stimolatori elettrici di nuova generazione e programmabili, abbiamo testato protocolli di stimolazione con onde rumorose ottenute da registrazioni dell’attività elettrica del muscolo nell’uomo. Esse sono già risultate più efficaci rispetto agli impulsi stereotipati generalmente usati in clinica, poiché variando in modo random in ampiezza, durata e frequenza, esse riducono dolore e fatica muscolare durante l’elettrostimolazione. Stiamo ora studiando la relazione tra i pattern di stimolazione e la quantità di miochine rilasciate auspicandoci di poter ottimizzare i protocolli di stimolazione elettrica oggi utilizzati in clinica per migliorarne l’efficacia.
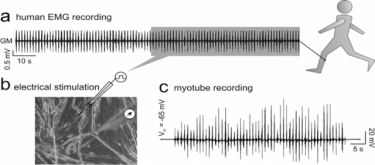
Esempio di traccia campionata da una registrazione EMG umana per disegnare un pattern di stimolazione “rumoroso” (a) applicabile a miotubi in coltura (b). Nel riquadro, l’ingrandimento del pattern di stimolazione “rumoroso” mostra la natura stocastica dell’attività a burst (c).
3) I canali Piezo1 e la meccanotrasduzione nella rigenerazione del muscolo scheletrico
La comprensione dei meccanismi coinvolti nella meccanotrasduzione ha compiuto passi da gigante dopo l’identificazione delle due proteine meccanosensibili Piezo1 e Piezo1. Piezo1 è un canale ionico di membrana a conduttanza cationica capace di “sentire” e convertire stimoli meccanici in segnali fisiologici in diversi tipi di cellule. La proteina si attiva in risposta alle variazioni della tensione della membrana cellulare indotte da modificazioni della composizione fosfolipidica (“force from lipid”), ma anche dalle interazioni della stessa con la matrice extracellulare e con il citoscheletro (“force from filament”). Così facendo, la proteina coordina la proliferazione, la migrazione e il differenziamento in diversi tipi di cellule. Inoltre, la possibilità di un’attivazione chimica, grazie alla disponibilità di agonisti specifici, ha reso il canale ionico Piezo1 un potenziale bersaglio farmacologico per la prevenzione e la cura di molte patologie.
Il nostro laboratorio è stato uno dei primi ad aver identificato i canali ionici Piezo1 nei precursori miogenici e nelle fibre muscolari adulte e ipotizziamo che Piezo1 possa essere un importante trasduttore di segnali meccanici come quelli generati durante la contrazione muscolare. Il nostro obiettivo è ora la caratterizzazione delle vie di trasduzione controllate dai canali ionici Piezo1, con una particolare attenzione a quelle coinvolte nel controllo dell’eccitabilità della membrana e alle vie di segnalazione Ca2+ mediate, fondamentali sia per il differenziamento miogenico che per la contrazione. Riteniamo che i nostri risultati possano contribuite alla messa punto di nuove strategie che vedono nel canale ionico Piezo1 il bersaglio farmacologico importante per contrastare gli effetti causati dall’invecchiamento, dal disuso e da eventi traumatici acuti e cronici sulla funzionalità del muscolo scheletrico.
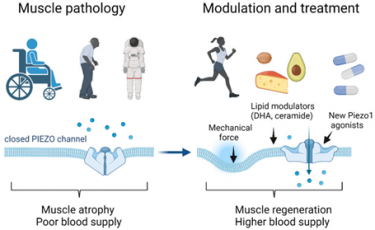
Il potenziamento dell’attività dei canali ionici Piezo1 mediante esercizio fisico, dieta o trattamento farmacologico può contribuire a contrastare i danni muscolari causati dal disuso, invecchiamento e mancanza di gravità ((da Bernareggi et al.,. Int J Mol Sci. 2022 doi: 10.3390/ijms23126616).




