Il laboratorio del Prof. Tongiorgi ha dato un importante contributo alla comprensione delle funzioni biologiche del Brain-Derived Neurotrophic Factor (Fattore neurotrofico derivato dal cervello, BDNF). In particolare, il team del prof. Tongiorgi ha dimostrato che le varianti di splicing BDNF formano un codice spaziale e quantitativo per l'espressione locale e la modulazione della morfologia dei dendriti durante lo sviluppo. Il gruppo ha inoltre studiato le forme proteolitiche del BDNF come biomarcatori di stress cronico, depressione, sclerosi multipla, autismo e deterioramento cognitivo nella schizofrenia. Il laboratorio fa parte della “Rete italiana su BDNF” (In-BDNF). La ricerca attuale è focalizzata su sviluppare dei metodi per il recupero dell'atrofia neuronale nei disordini del neurosviluppo, in particolare nella sindrome di Rett. Tali metodi sfruttano il codice di espressione delle varianti BDNF e trattamenti farmacologici ai quali si associa il monitoraggio dell’efficacia della cura mediante biomarcatori presenti nel sangue o nel liquor.
1) Recupero farmacologico dell'atrofia neuronale nella sindrome di Rett
La perdita di peso cerebrale, il restringimento della corteccia i cui neuroni si presentano con atrofia del corpo cellulare e dell’arborizzazione dendritica in assenza di processi neurodegenerativi sono alcune delle caratteristiche principali della Sindrome di Rett (RTT). La RTT è una malattia genetica dello sviluppo neuronale legata all'X causata principalmente da mutazioni nel MeCP2 (Methyl-CpG binding protein- 2) gene. Le principali ipotesi per le cause di atrofia neuronale implicano fattori intrinseci ed estrinseci che comprendono una compromissione del supporto neurotrofico a causa della ridotta produzione di BDNF, una diminuzione della neurotrasmissione di monoammine, un aumento dello stress ossidativo e un’alterata comunicazione tra neuroni e glia. Di conseguenza, stiamo testando l'antidepressivo Mirtazapina e altri farmaci per migliorare la trasmissione monoaminergica e il signaling dei fattori neurotrofici, ridurre lo stress ossidativo e contrastare l'atrofia neuronale. Il progetto sta utilizzando i modelli in vivo e colture neuronali da topo MeCP2 ko e colture neuronali derivate da fibroblasti dei pazienti.
Risultati traslazionali
1) Il laboratorio ospita il DRUG SCREENING CENTER FOR THE RETT SYNDROME, basato su un modello di sviluppo neurale in vitro ottenuto da cellule di topo altamente standardizzato adatto allo screening di composti chimici o naturali mediante analisi di high-content imaging (Nerli et al., 2020 – https://www.nature.com/articles/s41598-020-59268-w ).
2) Test di farmaci e composti naturali in modelli murini knock-out MeCP2 in vivo e in vivo per accelerare la traduzione verso studi clinici (approccio di riposizionamento - Bittolo et al., 2016 - http://dx.doi.org/10.1038/srep19796 ; Flores-Gutierrez et al., 2020 https://doi.org/10.1186/s11689-020-09328-z ).
2) Fattori neurotrofici e citochine come biomarcatori dell’atrofia neuronale e del suo recupero
Le attività di ricerca sono focalizzate sull'analisi dei fattori neurotrofici (in particolare BDNF) e delle citochine nel siero e nel liquido cerebrospinale per monitorare i trattamenti farmacologici e le terapie neuroriabilitative in pazienti con atrofia neuronale associata a patologie neuropsichiatriche o neurodegenerative.
Risultati traslazionali
1) Sviluppo e validazione di saggi innovativi in vitro per biomarcatori clinici di disturbi neurologici e neuropsichiatrici e monitoraggio di trattamenti farmacologici o terapie riabilitative.
2) Il laboratorio ha collaborato con varie società private come beta-tester di kit pre-commerciali.
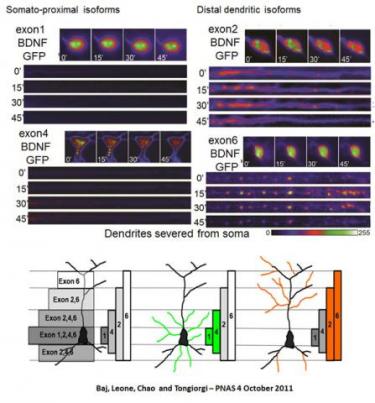
3) Il "codice spaziale e quantitativo" delle varianti di splicing BDNF
La neurotrofina Brain-derived neurotrophic factor (BDNF) è una molecola chiave di morforegolazione nello sviluppo neuronale e plasticità. La trascrizione del gene BDNF porta a 34 trascritti nell'uomo e 22 nei roditori, ciascuno con la stessa regione codificante (CDS), uno tra 11 differenti 5'UTR e un 3’UTR lungo o breve. Per spiegare il ruolo biologico di queste varianti di splicing del BDNF abbiamo proposto il modello del "codice spaziale e quantitativo". Questo modello si basa sulla nostra scoperta che gli mRNA codificanti per le varianti del BDNF diventano spazialmente segregati in risposta all'attivazione neuronale, all'interno di tre distinti domini subcellulari: il soma (esoni 1, 3, 5, 7, 8, 9a), i dendriti prossimali (esone 4) o i dendriti distali (esone 2, 6). Abbiamo inoltre dimostrato che ciascuna variante di mRNA ha una traducibilità diversa e produce quantità diverse di BDNF in risposta a diversi neurotrasmettitori. La ricerca attuale è focalizzata sulla comprensione dei meccanismi di segregazione e traduzione delle varianti di mRNA del BDNF e con l’obiettivo di utilizzare il codice spaziale e quantitativo del BDNF per il recupero dell'atrofia dendritica in varie malattie neurologiche
Risultati traslazionali
1) Saggio basato su cellule ad alta produttività brevettato per lo screening di composti naturali e sintetici in grado di modulare la traduzione proteica del BDNF (PCT/EP2010/067081).
2) Database di codici spaziali BDNF nel cervello umano e di roditore per la progettazione razionale di strategie per il recupero dell’atrofia neuronale e del deterioramento cognitivo in diverse aree del cervello.